细胞凋亡(Apoptosis)也称为程序性细胞死亡,不同于细胞坏死,它是机体按照自身主动的并且是高度调控的死亡过程,是机体正常的细胞生理应答反应。
与坏死细胞不同,凋亡细胞表现出细胞核染色质紧密、细胞质收缩以及产生膜结合的凋亡小体,细胞凋亡的失调与多种疾病如癌症、自身免疫性疾病等相关。
细胞凋亡的检测有多种方法,主要包括基于形态学、DNA片段大小和生物学的各种功能性指标。本文主要介绍常用的基于流式细胞仪的检测方法,包括细胞膜表面磷脂酰丝氨酸检测和线粒体膜电位的检测。
磷脂酰丝氨酸检测原理为:在正常的活细胞中,磷脂酰丝氨酸(phosphotidylserine,PS)位于细胞膜的内侧,在早期凋亡的过程中,PS 从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中(图片来自ThermoFisher website)。
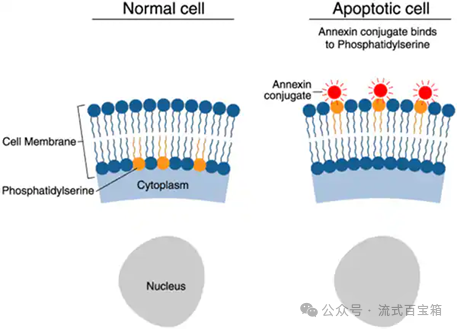
Annexin-Ⅴ(膜联蛋白-V)是一种Ca2+依赖性磷脂结合蛋白,能与PS高亲和力结合,可通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的胞膜结合。在这种检测方法中,常结合另外一种染料如碘化丙啶(Propidium Iodide,PI)用来区分存活细胞和坏死或凋亡细胞。PI是一种核酸染料,它不能透过正常细胞或早期凋亡细胞的完整的细胞膜,但可以透过凋亡晚期和坏死细胞的细胞膜。因此,将Annexin V与PI联合使用时,PI 则被排除在活细胞(Annexin V-/PI-)和早期凋亡细胞(Annexin V+/PI-)之外,而晚期凋亡细胞和坏死细胞同时被FITC 和PI 结合染色呈现双阳性(Annexin V+/PI+),如下图。
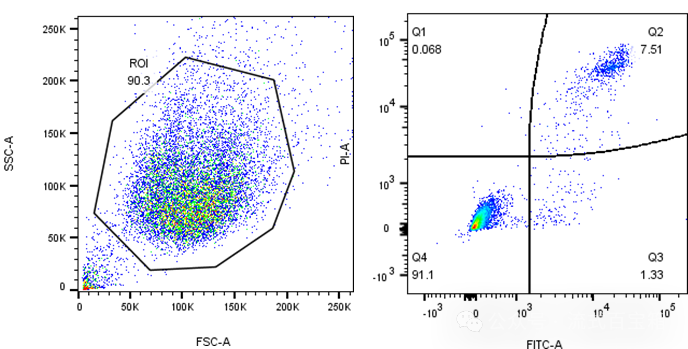
凋亡实验原理简单,但在流式上机中也会出现一些常见的问题如对照组中凋亡细胞比例过多、死细胞比例特别高。这种现象常见的原因是细胞样品处理不当。特别是对于贴壁细胞,消化是一个关键步骤。
对于贴壁细胞,一般用胰酶消化成单细胞悬液。胰酶消化时间过短,细胞可能消化不完全,需要用力吹打才能脱落,容易造成细胞机械损伤;消化时间过长也会造成细胞膜一定程度的损伤。最好是在加入胰酶消化后及时在显微镜下观察,待细胞间松散后即可终止消化。
因为Annexin-Ⅴ是Ca2+ 依赖性磷脂结合蛋白,胰酶中尽量不要含有EDTA,以免影响Annexin-Ⅴ和PS的结合。对于比较难以消化的贴壁细胞,可以加入少量EDTA,但在后续步骤中一定要洗涤干净。
还有,在处理细胞凋亡流式数据时,在FSC/SSC圈门时,一定要把FSC信号变小,SSC信号变大的那部分细胞也圈上。
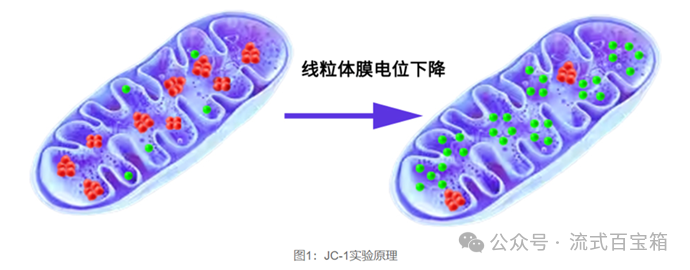
除了Annexin-Ⅴ/PI检测细胞凋亡,线粒体膜电位也常用于早期的细胞凋亡检测。线粒体膜电位的下降是细胞凋亡早期的一个标志性事件。基本原理如下图:JC-1荧光探针在线粒体膜电位较高时,聚集在线粒体的基质(matrix)中,形成聚合物(J-aggregates),可以产生红色荧光;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体(monomer),可以产生绿色荧光。这样就可以非常方便地通过荧光颜色的转变来检测线粒体膜电位的变化(图片来源于Elabscience)。
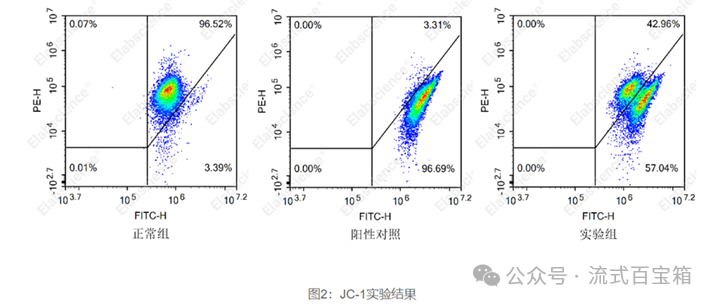
实际实验中,我们得到的膜电位流式数据可能和上图展示的并不一致。因为细胞群体中,每个细胞的膜电位的动态并不会完全一致,实际圈门策略需根据具体数据进行gate。
上面介绍了常用的两种细胞凋亡的检测方法。其它方法如Caspase-3活性检测、周期sub-G1检测本文不再赘述。为确保实验的准确性,在平时流式上机中,可以选择其中的两种方法进行相互验证。

