由于缺乏机体免疫系统筹的保护,体外培养的细胞没有对微生物的防御能力。在体外培养环境中,有些微生物在摄取营养物质方面有竞争优势,并在短时间内排出大量代谢产物;有些微生物则附着在细胞表面或进入细胞内部。因此,微生物污染会对体外培养细胞的正常生存、生长及功能活动造成极大干扰,严重的可致细胞死亡。同时,实验结果的准确性和可靠性也大打折扣。所以,保持细胞生存环境无微生物污染是体外实验的前提条件。良好的无菌操作可大大降低细胞培养中的微生物污染风险。
微生物对细胞的影响因污染物和细胞种类的不同而表现各异,一般当污染物持续存在时,轻者细胞增殖生长缓慢,分裂相减少,细胞变粗糙,轮廓折光增强;重者细胞停止增殖,细胞质中出现大量堆积物,细胞变圆或从瓶壁脱落。
若发生微生物污染,一般应及时将被污染的培养物及相关试剂在灭菌后按正规程序丢弃,与被污染培养物接触过的器材也应及时消毒灭菌,防止污染的再次发生。微生物污染的消除非常困难,且应保持隔离并严密监控,因此不要轻易尝试消除污染,除非细胞至关重要且不可替代。由此可见微生物污染的预防十分重要。为此,首先介绍如何判断常见的污染。
常见污染细胞的微生物有细菌、真菌、支原体、病毒等,不同污染物对细胞的影响有区别,真菌和细菌繁殖迅速,能在很短时间内(如48 h)压制细胞生长或产生有毒物质,而支原体和病毒对细胞形态和机能的影响是长期的、缓慢的和潜在的。细菌、真菌的污染可通过肉眼和常规显微镜观察到,支原体、病毒污染的确定则一般需借助其他检测方法。
㈠细菌污染
细菌是一类细胞细而短(细胞直径约0.5 μm,长度约0.5 ~ 5 μm)、结构简单、细胞壁坚韧、以二等分类方式繁殖和水生性较强的原核微生物。细菌增殖速度很快,能短时间在培养系统内产生大量细菌,从而导致培养基浑浊(有时静置的培养基初看不浑浊,但稍加振荡,就有很多浑浊物漂起;有时在培养基表面会出现轻微的薄膜或泡沫,或在培养物生长表面出现点状物,移动培养器皿时则消散)并变为黄色(细菌污染后大多能改变培养基pH)。用倒置相差显微镜观察,视野内可见点状的细菌颗粒,并可能出现由细菌迁移引起的闪动,一些细菌会成团或结合培养的细胞。
在细菌污染初期,若使用了抗生素,其繁殖处于抑制状态,细胞生长不受明显影响,污染情况用倒置相差显微镜也不易观察、判断,此时若怀疑有细菌污染,可用无抗生素的培养液常规培养观察。若未使用抗生素,培养液改变不明显,但又疑有污染,可取一份培养基样本接种到营养琼脂培养检测。
需注意细菌污染有时可能会和培养基组分的沉淀或细胞碎片混淆,但细菌形态一致,而沉淀或碎片则形态不同,并且通常大小不一;细菌团可能与沉淀的蛋白质混淆,但细菌团内可见很多单个或成串的细菌(特别是晃动后),蛋白质沉淀则不然。
细菌数量较多时会使原先清晰的培养背景变得模糊,甚至覆盖培养物,对培养物的生存构成直接的威胁。迅速增殖的细菌,会消耗营养液和产生毒素从而抑制细胞生长,毒性大的细菌会很快导致细胞崩解死亡。
㈡支原体污染
支原体是介于细菌和病毒之间能独立生活的最小微生物,无细胞壁,形态多变,大小介于0.2 ~ 2 μm之间,多吸附在细胞表面或散在于细胞之间。不同支原体的生物学性状有很大差别,一般对热敏感,对青霉素普遍有抗药性。由于支原体无致死细胞毒性且可与细胞长期共存,故培养基一般不发生浑浊,无明显变化,或有微细变化却由于传代和换液而被缓解。除了细胞培养状况不佳,采用常规显微镜并不容易观察支原体污染,其检出需借助荧光染色、PCR、ELISA、免疫染色、放射自显影术、微生物学分析等方法,其中采用核酸荧光染料进行DNA染色是最简单和最可信的方法之一。
当进行荧光染色时,在40×或100×物镜下支原体可被显示为细胞质上明确的微粒或丝状染色,一般大小、性质一致,此时同样被亮染的培养细胞的细胞核可作为阳性对照。确定是否存在支原体污染需尽可能多地观察染色样本,因为不是所有培养的细胞都会被污染。
用荧光染色法进行支原体检测时,培养物的细胞碎片可能会造成假阳性结果,但细胞碎片不会出现清晰的点状或丝状支原体形态。若仍不能确认,可吸取适量待检培养基与指示细胞(为已明确无支原体污染且是支原体的适宜宿主,同时生长良好,有足够的细胞质以显示粘附的支原体,如MDCK细胞)共培养,然后荧光染色来观察指示细胞表面是否有支原体,从而避免误判。
运用荧光染色法有时会观察到细胞质存在均匀亮染,这可能是由RNA引起的,这类荧光会逐渐变暗,可将染色样本干燥避光保存后在第2天观察。如果对荧光检测的结果存在怀疑,可重复检测或采用其他方法再次检测。
支原体可黏附在宿主细胞表面,从细胞膜获取脂质和胆固醇,造成细胞膜损伤。支原体能抑制细胞代谢和生长,改变核酸合成,影响细胞抗原性,导致染色体畸变,干扰病毒复制以及具有类似病毒的作用。不同细胞对支原体的感受性和反应存在差异。
急性支原体污染可能会引起培养细胞状况的全面恶化,但很多支原体生长缓慢且不破坏宿主细胞(特别是连续培养的细胞株),它们可通过很多不同的途径改变培养物的行为和代谢。若细胞被支原体长期污染,会出现增殖减慢、饱和密度下降等,污染严重的情况下细胞会从培养器皿脱落,另外悬浮培养的细胞还会出现凝集现象。
㈢真菌污染
真菌是一类低等的真核生物,无法进行光合作用,以孢子进行繁殖,一般有发达的菌丝体,异养吸收型,陆生性较强。真菌种类繁多,形态各异,若发生真菌污染,大多肉眼可见白色或浅黄色小点漂浮于培养基表面,短期内培养基多不浑浊,某些真菌污染会导致培养基的pH升高;显微镜下观察,可见丝状、管状或树枝状菌丝纵横于细胞之间,悬浮在培养液之中,有时还会产生孢子团,酵母菌和念珠菌则表现为独立的卵圆形颗粒,并可能出芽。真菌生长迅速,能在短时间内抑制细胞生长或产生有毒物质杀死细胞,且会在培养板孔间蔓延而很快波及邻孔。
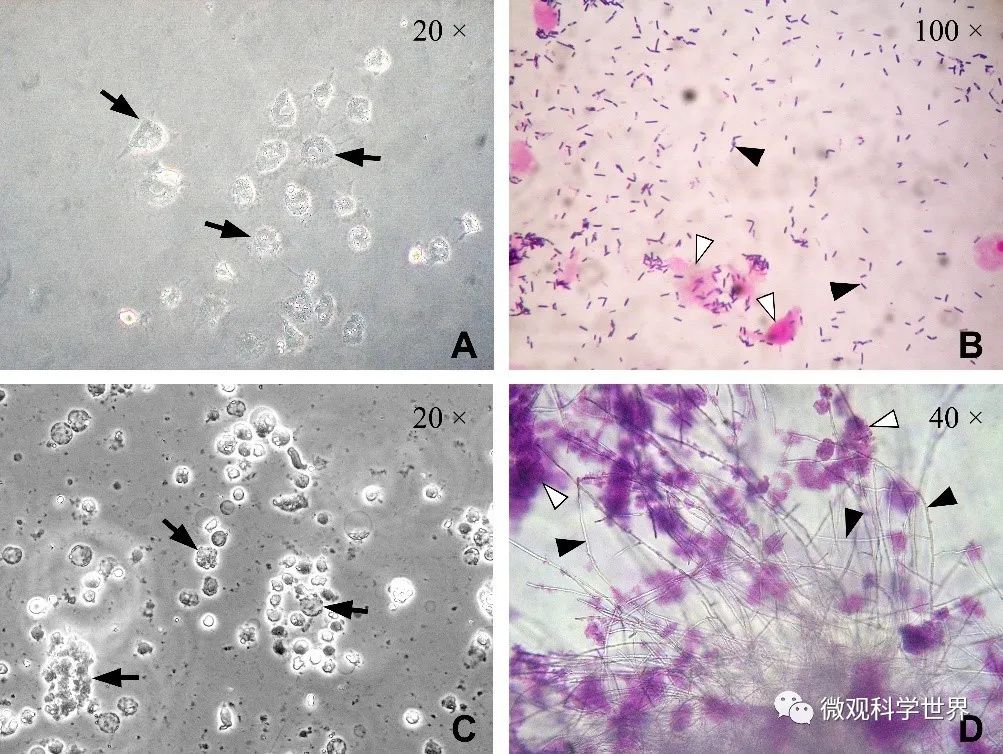
细胞培养实验常见微生物污染示例 (A)培养中的神经细胞被细菌污染的早期表现,从胞质开始出现形态改变(↑所示);(B)杆菌污染的革兰染色诊断,▲ 示革兰阳性杆菌,Δ 示细胞碎片;(C)支原体污染的表现之一,细胞出现萎缩和碎片化的改变(↑所示,确诊需要结合分子标志物检测);(D)霉菌污染,硫堇染色,▲ 示菌丝,Δ 示细胞碎片。
㈣病毒污染
病毒为一种大小以纳米计、不能独立地利用外界营养物质进行自体繁殖的微生物。病毒种类复杂,相应宿主细胞有特异性,而感染了病毒的宿主细胞形态学上不一定有显著的特异性改变,因此仅靠目测或显微镜观察不能达到检测目的。应根据不同的病毒选用不同的方法来检测,常规有红细胞吸附试验、动物接种检查、电子显微镜检查、免疫学检测和PCR等,因属病毒学的研究范畴,普通实验室不易推广。病毒进入细胞后,可改变培养物的生物学性状,影响培养细胞的生长或干扰实验结果的客观性。
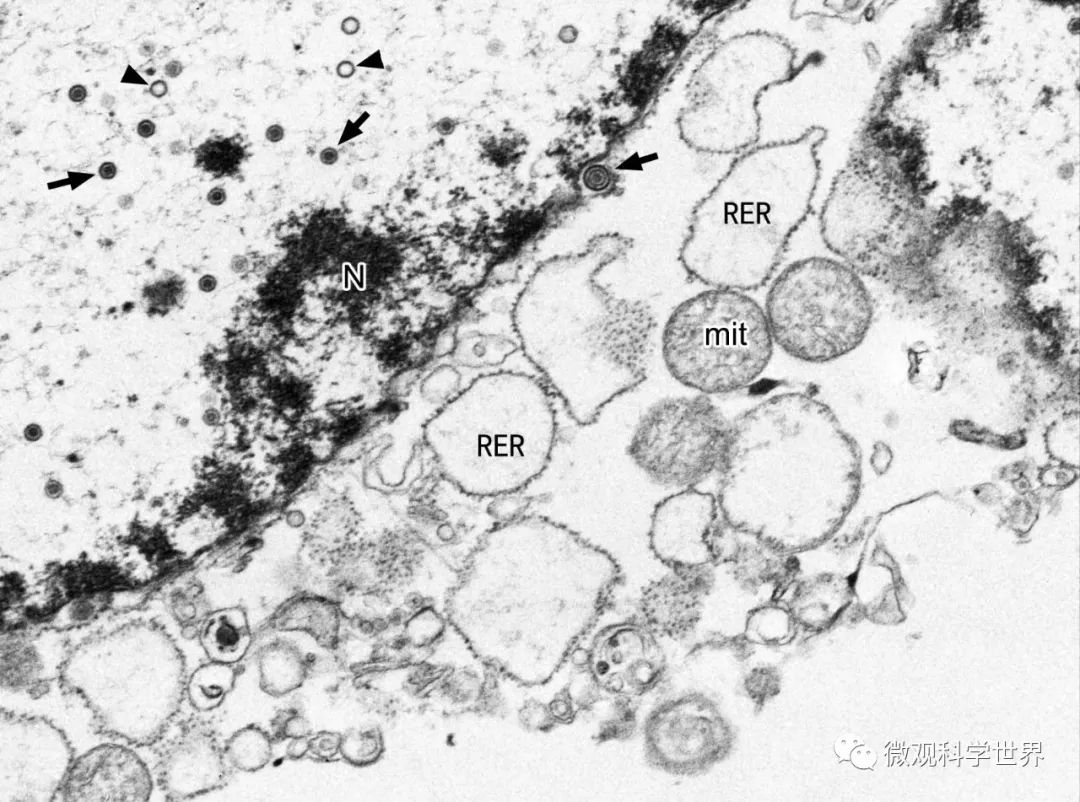
病毒感染培养细胞TEM成像 → 完整病毒;▲ 病毒衣壳;N 细胞核;RER 扩张的粗面内质网;mit 线粒体。细胞膜已破损。
为杜绝上述污染,可从以下几个方面做好预防工作:
(1)培养环境:
1)无菌室:保持清洁,经常擦洗,使污染物不易积聚。
2)超净台:①定期维护和保养,按厂家规定定期清洗和更换空气滤器,经常保持清洁并用75%乙醇消毒;②操作前提前30 min启动超净台紫外灯消毒;③存放的物品应全面消毒,并尽可能只将立即使用的物品放入;④细胞培养操作时应尽量保持层流,避免气雾状污染物进入培养器皿;⑤操作中溅出的液体应及时擦去,并用75%乙醇擦拭消毒;⑥实验完毕后,移走所有物品,并彻底用75%乙醇擦洗工作台。
3)二氧化碳培养箱:①由于箱内潮湿,温度适宜,有利于微生物生长,故应定期对培养箱进行清洁和消毒处理。将隔板、水盘和可拆卸部分取出,按去污剂擦洗、清水冲洗、消毒剂擦洗、紫外线照射30min的顺序处理,然后放回箱内;②水盘内使用灭菌蒸馏水或添加真菌抑制剂如硫酸铜(会腐蚀不锈钢等材质的水盘)或专用灭菌水,并注意及时更换新鲜水;③尽量减少开门次数,降低污染机会;④若取存细胞时不慎将培养液漏出,经及时用75%乙醇擦拭消毒。
(2)物品的消毒灭菌:①操作前应做好所用器皿、试剂的消毒灭菌工作;②高压蒸汽灭菌是最常用的方法,不能采用此法灭菌的器皿、试剂,应采用其他消毒灭菌方法,如培养基等试剂可过滤除菌,盖玻片等器械可用75%乙醇浸泡消毒后置于无菌环境中晾干;③若物品消毒灭菌后长时间未使用,应重新处理。
(3)个人卫生:操作前洗净双手,操作时穿清洁的长外衣,同时佩戴无菌的手套、口罩和帽子,手套经常用75%乙醇擦拭消毒。
(4)无菌操作:防止污染的关键在于严格无菌操作。无菌意识不强、动作不准确、操作不熟练等都会造成污染。注意事项主要如下:①细胞培养的操作一定要在超净台等层流装置内进行,无菌的试剂、器械一定要在无菌区开封;②操作时减少交谈、咳嗽等防止来自唾沫和呼出气流造成的污染;③培养试剂不宜过早开瓶,操作时应尽可能保持瓶体倾斜,所有瓶口不能与超净台的风向相逆,使用后应立即封闭瓶口;④培养的细胞处理前也不要过早暴露于空气中;⑤不要在打开器皿上方操作;⑥不允许用手触及器皿的无菌部分(如瓶口、瓶盖内侧);⑦吸取液体时应专管专用,及时替换;⑧若无菌器物的尖端接触到非无菌物品表面,应及时更换;⑨为确保培养物的安全,应尽早冻存有价值的培养物;⑩对新引进的细胞株、血清等生物材料应先隔离培养观察,防止外来的污染源。
(5)抗生素:没有哪种抗生素都能抑制所有微生物,即使联合使用也难以根除污染。抗生素对细胞生长有一定影响,由抑菌引起的共生现象亦可导致实验假象;持续使用会导致慢性微生物污染(在这种情况下,微生物被抗生素抑制,但没有被杀死,它们会在培养体系中存留,大部分时间检测不到,但当条件改变时会再次出现),同时还会使微生物产生抗药性的几率大大增加,因此其使用需谨慎,不要让培养物长期处于抗生素中。只要操作与条件合格,最好不添加。

