
Homotypic Membrane-Enhanced Blood−Brain Barrier Crossing and Glioblastoma Targeting for Precise Surgical Resection and Photothermal Therapy
同型膜增强对BBB的穿越和对胶质母细胞瘤的靶向以用于精准手术切除和光热治疗
Journal of the American Chemical Society. 2023
主讲人:张俊,2024年6月11日
研究进展:
神经胶质瘤是一种原发性中枢神经系统肿瘤,威胁着从儿童到成人的全球人群。在各种胶质瘤中,胶质母细胞瘤(GBM)是最致命的一种。在目前的治疗下,GBM患者的中位生存期仅为18个月,5年生存率仅为10%。根据不同的病例,已经建立了两种典型的治疗方法,手术和非手术。作为一种标准方法,手术配合化疗和/或放疗是大多数晚期GBM患者的首选,其治疗效果与手术切除的准确性高度相关。由于GBM的高复发率,限制性手术切除导致预后差,而侵入性切除导致包括运动和语言在内的关键神经功能损伤。虽然事先可以仔细检查GBM在脑内的形态和位置,但在手术过程中很难确定GBM的边界。因此,由于术中导航引导切除的缺乏,手术治疗GBM的效果并没有得到很大的改善。另一方面,如果GBM处于早期或脑深部,非手术治疗将是更好的选择。由于避免了手术不可避免的损伤,非手术治疗已成为治疗各种肿瘤的有力手段。目前的非手术治疗GBM主要是通过对识别分子的修饰来完成的,如谷胱甘肽和转铁蛋白。然而,由于大脑独特的结构和功能特征的限制,缺乏额外识别分子的非手术治疗GBM很少有报道。
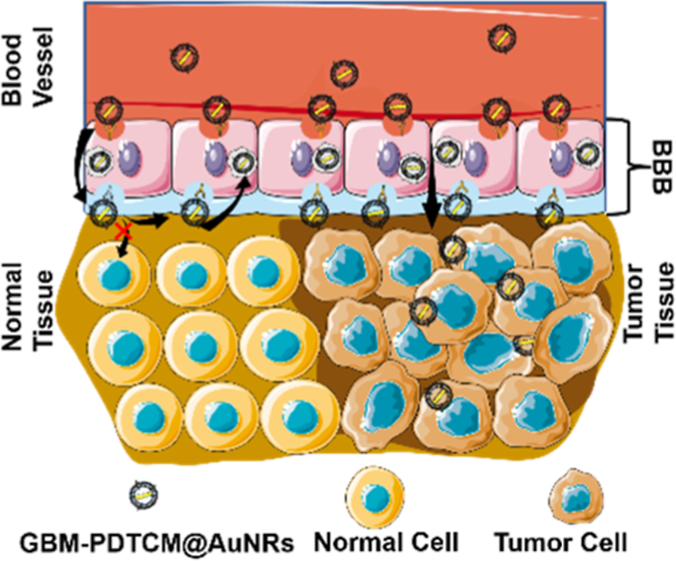
血脑屏障(BBB)通过控制外源性化合物的转移来保护大脑同时,GBM具有高浸润性,在脑内生长无明显边界。为了完成引导手术和非手术治疗GBM,功能剂(造影剂和治疗剂)需要在GBM病变处起作用。因此,如何使功能药物有效地穿过血脑屏障,选择性地靶向GBM成为两种治疗方法共同面临的问题。用于GBM手术的临床造影剂能够穿过血脑屏障,但不能靶向GBM细胞为实现肿瘤靶向,用识别分子装备功能药物是一种有代表性的方法,但这种策略在制备过程中存在连锁效率低的问题。靶分子在循环中的潜在损失,以及对GBM患者的严重副作用。最近的研究表明,正常细胞膜上的一些抗原可以延长药物在循环中的滞留时间,被动地驱动更多的药物通过血脑屏障进入大脑。此外,肿瘤细胞膜上的一些特异性抗原负责同源粘附,从而有利于实现同型肿瘤靶向。考虑到GBM细胞起源于脑胶质细胞,因此GBM细胞膜在保持同型肿瘤靶向能力的同时,具有高效穿过血脑屏障的潜力。值得注意的是,GBM患者源性肿瘤细胞膜(GBM- PDTCM)可能比GBM细胞膜与GBM肿瘤具有更高的同源性。基于上述原因,GBM- PDTCM包覆功能剂可能是一种同时增强血脑屏障跨越和肿瘤靶向的新策略,从而为引导手术和非手术治疗GBM奠定基础。
研究内容:
本文通过用GBMPDTCM包裹金纳米棒(AuNRs),形成了一种纳米复合材料(GBM-PDTCM@AuNRs)来处理不同阶段的GBM(方案1)。在这种纳米复合材料中,AuNRs作为表面增强拉曼散射(SERS)基板,并表现出明显的光热效应。同时,GBM-PDTCM作为亲脂性荧光基团的载体,对GBM进行同型靶向。更重要的是,GBM-PDTCM能够诱导血脑屏障跨越,这比报道的被动血脑屏障跨越更有效。由于上述特点,GBMPDTCM@AuNRs可以高效地穿过血脑屏障,选择性靶向GBM细胞,并在GBM病变处同时产生拉曼和荧光信号。因此,由于双模态对比,晚期GBM采用引导手术治疗,而早期GBM则依靠光热治疗(PTT)进行非手术治疗。结果表明,原位异种移植小鼠的GBM病变可以被精确切除,PTT治疗后小鼠的中位生存时间由25天延长至52天。
要点:
(1)基于GBM-PDTCM与脑细胞膜的高度同源性,GBM-PDTCM@AuNRs可实现高效的BBB穿越和选择性的GBM靶向。同时,由于功能化修饰了拉曼报告器和亲脂性荧光团,因此GBM-PDTCM@AuNRs能够在GBM病灶处产生荧光和拉曼信号。在双重信号的指导下,实验可在15 min内对几乎所有肿瘤进行精确地手术切除,进而极大地改善对晚期GBM的手术治疗。
(2)在原位异种移植小鼠肿瘤模型中,研究者通过静脉注射GBM-PDTCM@AuNRs的方式进行了肿瘤光热治疗。该治疗能够使小鼠的中位生存时间增加一倍,有效改善对早期GBM的非手术治疗效果。综上所述,得益于同型膜增强的BBB穿越和GBM靶向,GBM-PDTCM@AuNRs能够以不同的方式治疗全期GBM,从而为脑肿瘤的治疗提供了新的思路。
总结与展望:
GBM-PDTCM@AuNRs可以通过精确手术切除和光热治疗来治疗GBM。由于该细胞膜来自患者的GBM组织,GBM-PDTCM@AuNRs与脑细胞高度同型,因此能够有效地穿过血脑屏障,选择性地靶向GBM组织。利用AuNRs作为SERS底物,利用GBM-PDTCM负载亲脂性荧光团,GBM-PDTCM@AuNRs能够在肿瘤中心产生强烈的荧光信号,在肿瘤边缘产生敏感的拉曼信号。因此,通过荧光成像和拉曼光谱相结合,可以完全准确地去除U-87 MG原位异种移植小鼠的GBM组织,在极短的时间内最大限度地提高GBM手术的肿瘤去除率。此外,GBM-PDTCM促进GBMPDTCM@AuNRs进入GBM细胞,促进AuNRs的光热效应。结果,通过静脉注射GBM-PDTCM@AuNRs, U-87 MG原位异种移植小鼠的GBM组织因PTT而收缩,显著增加小鼠的中位生存时间。这项工作体现了同型膜在设计肿瘤治疗系统中的巨大价值,为全期GBM的治疗提供了另一种视角。

